|
Element ve Bileşiklerin Özellikleri (Konu Anlatımı)
|
|
B- ELEMENT VE BİLEŞİKLER :
1- Elementler ve Elementlerin Özellikleri :
a) Elementler :
Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir.
Elementler çok sayıda atomdan oluşur ve elementleri oluşturan atomlar aynı cins atomlardır. Çok sayıda aynı cins atom birleşerek görünür boyuta geldiklerinde elementleri oluştururlar.
Bir elementi oluşturan bütün atomların büyüklükleri yani şekilleri (ve atomları arasındaki uzaklık) aynıdır. Fakat bir elementin atomları ile başka bir elementin atomlarının büyüklükleri yani şekilleri farklıdır (ve atomları arasındaki uzaklık).
Elementi oluşturan atomların birbirine olan uzaklığı elementin katı, sıvı ve gaz haline göre değişebilir.
Örnek :
• Demir elementini oluşturan atomlar demir atomlarıdır. Demir elementini
oluşturan en küçük tanecikler demir atomlarıdır. Demirden yapılmış farklı maddeler de aynı demir atomlarından oluşurlar.
• Bakır elementini oluşturan atomlar bakır atomlarıdır. Bakır elementini oluşturan en küçük tanecikler bakır atomlarıdır. Bakırdan yapılmış farklı maddeler de aynı bakır atomlarından oluşurlar.
• Demir elementini oluşturan demir atomları ile bakır elementini oluşturan bakır atomları birbirinden farklı büyüklüktedir.
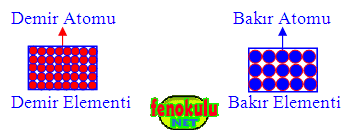
b) Element Çeşitleri :
1- Atomik Yapıdaki Elementler :
Bazı elementleri oluşturan aynı cins atomlar doğada tek başlarına bulunurlar. Böyle atomlara sahip elementlere atomik yapılı elementler denir. Atomik yapılı elementlerin en küçük taneciği atomlardır.
Örnek: Demir, bakır, alüminyum, çinko, kurşun, altın gibi elementler atomik
yapılıdır.
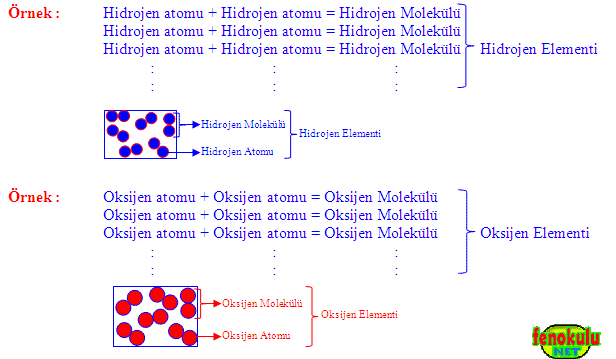
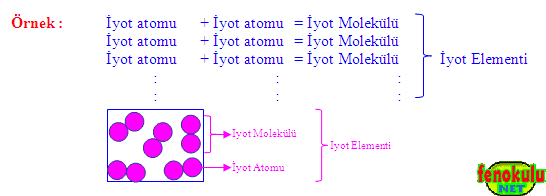
2- Moleküler Yapıdaki Elementler :
Bazı elementleri oluşturan aynı cins atomlar doğada ikili gruplar halinde bulunurlar. Böyle atomlara sahip elementlere moleküler yapılı elementler denir. Moleküler yapılı elementlerin en küçük taneciği moleküllerdir.
Örnek: Hidrojen, oksijen, iyot, karbon, fosfor, kükürt, azot…
c) Elementlerin Özellikleri :
1- Kendi özeliğini taşıyan en küçük yapı birimleri atomlardır.
2- Aynı cins atomlardan oluşurlar.
3- Kendinden daha basit ve farklı maddelere ayrılamazlar.
4- Saf maddelerdir.
5- Sembollerle gösterilirler.
SORU : 1- Bakır cezveyi oluşturan tanecikler arasında fark var mıdır?
2- Demir parmaklığı oluşturan tanecikler ile bakır cezveyi oluşturan tanecikler arasında fark var mıdır?
4. Etkinlik : Aynı Atomlar Toplandık (Ders Kitabı – 99)
Amaç : Demir parmaklığın modelini oluşturarak elementlerin aynı cins atomlardan
oluştuğunu kavramak.
Yapılacaklar : • Model yapılırken aslına benzemeyeceği belirtilir.
• Oyun hamuru eşit büyüklükteki küçük parçalara ayrılır ve bu parçalar yuvarlanarak küçük küreler yapılıp bunlar birleştirilir. Bu küreler demir parmaklığı oluşturan tanecikleri temsil eder.
• Demir parmaklığı aynı cins atomların oluşturduğu sonucuna varılır.
• Sonuca varalım kısmında;
– Tanecikler atomu ifade eder.
– Aynı çeşit tanecikler bir araya gelerek elementleri oluştururlar.
5. Alternatif Etkinlik : Farklı Malzeme Aynı Atom (Öğretmen Kitabı – 99)
Amaç : Demirden yapılmış maddelerin aynı demir atomlarından oluştuğunun
Kavratılmasını sağlamak.
Yapılacaklar : • Demirden yapılan maddelerin tanecik modelleri çizdirilir.
5. Etkinlik : Atom Aynı, Madde Aynı (Ders Kitabı – 100)
Amaç : Demir elementini oluşturan atomların bakır elementini oluşturan atomlardan
farklı olduğunu göstermek.
Yapılacaklar : • Günlük hayatta makroskobik olarak görülen demir ve bakırdan
yapılan maddeleri oluşturan atomları modellerler.
• Üç–dört kişilik gruplar oluşturulur.
• Her gruba iki farklı renkte oyun hamuru verilir.
• Gruplar farklı renkteki oyun hamurları ile demir ve bakırdan yapılan maddelerin bir kısmını oluşturan atomların küre şeklinde modelleri oluşturulur.
• Küre şeklindeki modeller birleştirilir.
• Yapılan modeller deftere çizdirilir.
• Sonuca varalım kısmında;
– Tanecikler atomu ifade eder.
– Aynı çeşit tanecikler bir araya gelerek elementleri oluştururlar.
– Oluşturulan demir ve bakır atomları farklı atomlardır.
– Demir ve bakır farklı elementler olduğu için onların atomlarının büyüklükleri farklıdır ve onlar modellenirken farklı büyüklükte ve renkte oyun hamurları kullanılmalıdır.
10. Etkinlik : Soru İşaretini Kaldıralım, Yerini Dolduralım (Çalışma Kitabı – 52)
Amaç : Farklı maddeleri oluşturan atomların farklı olduğunu farklı şekilde çizerek
göstermek.
Yapılacaklar : • Demir parmaklığın, bakır cezvenin ve alüminyum tencerenin
atomlarını birbirinden farklı çizerler.
• Taneciklerin birbirinden farklı olduğunu gösterirken farklı renkler kullanılır. Ama taneciklerin renklerinin olmadığı söylenir.
• Çizimler üzerinde atomlar ve elementler gösterilir.
• Ders kitabının 96. sayfasındaki fındık, kiraz ve kestane resimlerine dikkat çekilir.
6. Etkinlik : Atom Kümeleri (Ders Kitabı – 101)
Amaç : Aynı çeşit atomların bir araya gelerek atom kümlerini, bu atom kürelerinin de
birleşerek elementleri oluşturduğunun fark edilmesini sağlamak.
Yapılacaklar : • Üzerinde maddelerin tanecik modellerinin yer aldığı kartlar
hazırlanır.
• Boncuklar ip ile birbirine bağlanarak kartlarda gösterilen modeller oluşturulur ve modeller kibrit kutularına yerleştirilir.
• Oluşturulan modellerin şekli deftere çizdirilir.
• Çizim üzerinde her model için bir atom kümesi ve bu atom kümesini oluşturan atomlar işaretlenir.
• Oksijen ve hidrojen elementi gaz halindedir. Bu nedenle bu elementlerin modelleri yapıldıktan sonra kutuya konur ve atom kümelerinin arasında boşluk bırakılır.
• Element atomlarının arasındaki boşluğun farklı olmasının nedeni sorulur.
• Kartlarda bulunan elementlerin hangi hallerde olduğu sorulur.
• Sonuca varalım kısmında;
– Oluşturulan her modelde kaç çeşit atom olduğu sorulur.
– Yapılan hangi modelde atom kümelerinin bulunduğu belirtilir.
– Atom kümelerini oluşturan atomlar arasında fark olup olmadığı sorulur.
– Kartlarda verilen modellerin hangilerinin elementi temsil ettiği sorulur.
11. Etkinlik : Hangi Modeller Hangi Elementlere Ait? (Çalışma Kitabı – 53)
Amaç : Elementlerin atomik ve moleküler yapıda olduğunu göstermek.
Yapılacaklar : • Resimlerde verilen modellerden hangisinin elemente ait olduğu
sorulur.
• Etkinlikteki resimlerden a, b, c, e nin element olduğu, sebebinin de elementlerin tek cins atom içermesi olduğu söylenir.
2- Moleküller :
Aynı cins ya da farklı cins iki ya da daha fazla atomun (kimyasal bağlar ile) birbirine bağlanması sonucu oluşan atom gruplarına (yapıya) molekül denir.
Atomların çoğu doğada tek başlarına bulunmazlar. Aynı cins ya da farklı cins atomlar bir araya gelerek molekülleri oluştururlar ve doğada molekül halinde bulunurlar.
Moleküller iki ya da daha fazla atomdan oluşurlar. İki (az sayıda) atomdan oluşan moleküllere basit yapılı moleküller, çok sayıda atomdan oluşan moleküllere karmaşık yapılı moleküller denir. (500 atomdan oluşan moleküller bulunabilir).
Örnek : • Su, iyot, hidrojen, oksijen molekülleri basit yapılı moleküllerdir.
• Günlük hayatta kullanılan besinlerde ve hücrede bulunan karbonhidrat, protein ve yağ molekülleri karmaşık yapılı moleküllerdir.
a) Aynı Cins Atomların Molekülleri :
Aynı cins iki atom bir araya gelerek element moleküllerini, aynı cins element molekülleri de bir araya gelerek elementleri oluştururlar.
Bazı elementleri oluşturan aynı cins atomlar doğada tek başlarına bulunurken bazı elementleri oluşturan aynı cins atomlar da doğada ikili gruplar halinde bulunurlar. Doğada ikili gruplar halinde bulunan atomlara sahip elementlere moleküler yapılı elementler denir. Moleküler yapılı elementlerin en küçük taneciği moleküllerdir.
Hem elementler hem de element molekülleri aynı cins atomdan oluşur. Elementler çok sayıda atomdan oluşur ve görünür boyuttadır. Element molekülleri ise iki atomdan oluşur ve elementlerin yapı birimleridir (görünmez boyuttadır).
b) Farklı Cins Atomların Molekülleri :
Farklı cins atomlar bir araya gelerek bileşik moleküllerini, bu moleküller de birleşerek bileşikleri oluştururlar. Bu nedenle bileşikler farklı cins atomlardan oluşurlar ve bileşiklerin kendi özelliklerini taşıyan en küçük tanecikleri moleküllerdir.
Bileşiklerin moleküllerini oluşturan atomlar farklı cins atomlar oldukları için bu atomların büyüklükleri ve özellikleri de birbirinden farklıdır.
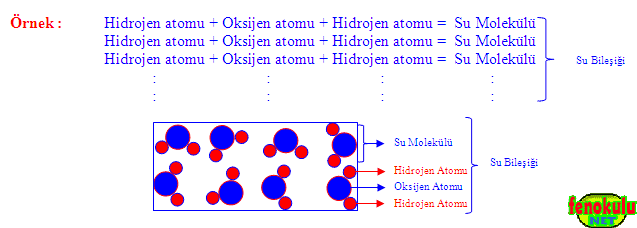
NOT : 1- Su molekülünde hem aynı çeşit hem de farklı çeşit atomlar bulunur.
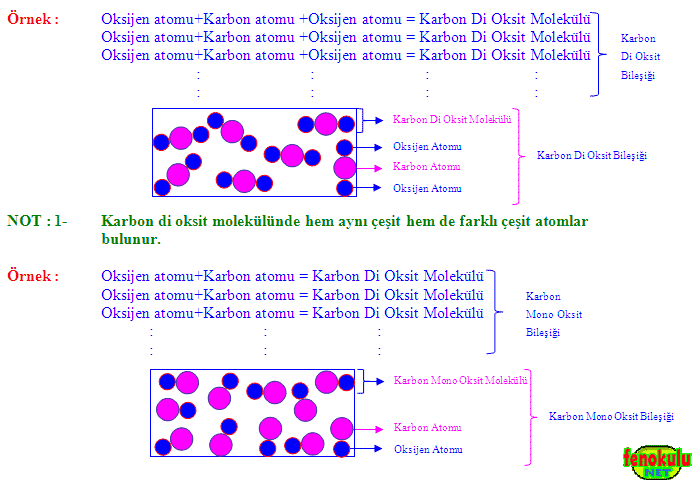
NOT : 1- Karbon di oksit molekülünde hem aynı çeşit hem de farklı çeşit atomlar
bulunur.
7. Etkinlik : Farklı Atomlardan Atom Kümesine (Ders Kitabı – 102)
Amaç : Oyun hamurlarından oluşturulan birbirinden farklı kürelerin belirli kurala
bağlı olmaksızın (farklı sayıda ve farklı çeşitte atom) bir araya getirilerek moleküllerin çeşitliliğinin fark edilmesinin sağlanması.
Yapılacaklar : • Öğrenciler gruplara ayrılır ve oyun hamurlarından farklı boyutlarda
küreler yapılır.
• İstenilen sayıda ve çeşitte küreler kürdan yardımıyla bir araya getirilerek molekül modelleri oluşturulur.
• Oluşturulan modellerin resimleri deftere çizdirilir.
• Yapılan modelleri öğrencilerin birbirlerine tanıtması ve aynı yere konularak incelenmesi sağlanır.
• Farklı renkteki küreleri birleştirerek atom kümesi oluşturabilir veya aynı renkte ve farklı büyüklükte küreleri birleştirerek atom kümesi oluşturabilir.
• Aynı veya farklı çeşit atom kümelerinin moleküller olduğu belirtilir.
• Sonuca Varalım Kısmında;
– Yapılan modeller arasında fark olup olmadığı sorulur ve farklı modellerdeki moleküllerin birleşerek farklı maddeleri oluşturduğu belirtilir.
– Molekül çeşitliliğinin maddenin çeşitliliğini sağladığı, molekül çeşitliliğini de atom çeşitliliğinin sağladığı belirtilir.
– Hangi modellerin aynı çeşit atomlardan oluştuğu sorulur.
– Hangi modellerin farklı çeşit atomlardan oluştuğu sorulur.
– Her modelin kaç farklı atomdan oluştuğu sorulur.
6. Alternatif Etkinlik : Bu Tanecikler Neye Ait? (Öğretmen Kitabı – 102)
Amaç : Taneciklerin ati olduğu maddenin tespit edilmesinin sağlanması.
Yapılacaklar : • Resimlerdeki taneciklerle ait oldukları maddeler eşleştirilir.
• Cezveyi oluşturan atomları, iyodu oluşturan molekülleri çok sayıda çizerek element oluşacağını kavramak.
• Suyu oluşturan molekülleri çok sayıda çizerek bileşik oluşacağını kavramak.
8. Etkinlik : Molekül Modelleri (Ders Kitabı – 103)
Amaç : Kartlarda verilen molekül modellerinin yapılmasını ve modeller üzerinde
aynı veya farklı cins atomların fark edilmesini sağlamak.
Yapılacaklar : • Öğrenciler gruplara ayrılır ve farklı renkte oyun hamuru ve kürdan
kullanılarak resimlerdeki molekül modelleri oluşturulur.
• Yapılan modeller sınıfa gösterilerek tanıtılır ve molekül modellerinin resimleri deftere çizilir. Çizim üzerinde aynı ve farklı atomlar gösterilir.
• Sonuca varalım kısmında;
– Modelde oluşturulan her bir molekülün kaç atomdan oluştuğu sorulur.
– Modelde oluşturulan her bir molekülün kaç çeşit atomdan oluştuğu sorulur.
– Hangi modeldeki moleküllerin aynı çeşit ve büyüklükteki atomdan oluştuğu sorulur.
– Hangi modeldeki moleküllerin elementleri oluşturduğu sorulur.
12. Etkinlik : Dondurmacı (Çalışma Kitabı – 54)
Amaç : Günlük hayatta karşılaşabilecek bir durumla molekül hakkında öğrenilen
bilgilerin karşılaştırılmasının sağlanması.
Yapılacaklar : • Atom, dondurma topuna benzetilir.
• Kartondan dondurma külahları yaptırılır ve dondurma olarak ikişer tane olmak üzere üç farklı renk bilye kullanılır. Üç farklı renk bilye, üç farklı elementi, dondurma toplarının oluşturduğu kümeler de molekülü temsil eder.
• Açık renk bilye vanilyalı, koyu renkli bilye çikolatalı, diğer bilye de çilekli dondurmayı temsil eder.
1- İki çeşit dondurma topundan iki toplu kaç farklı dondurma oluşacağı sorulur ve bunlar oluşturulur. (3)
– Vanilya – Vanilya
– Çikolata – Çikolata
– Vanilya – Çikolata
2- Üç çeşit dondurma topundan iki toplu kaç farklı dondurma oluşacağı sorulur. (6)
– Vanilya – Vanilya
– Çikolata – Çikolata
– Çilek – Çilek
– Vanilya – Çikolata
– Vanilya – Çilek
– Çikolata – Çilek
3- Üç çeşit dondurma topundan üç toplu kaç farklı dondurma oluşacağı sorulur. (10)
– Vanilya – Vanilya – Vanilya
– Çikolata – Çikolata – Çikolata
– Çilek – Çilek – Çilek
– Vanilya – Vanilya – Çikolata
– Vanilya – Vanilya – Çilek
– Çilek – Çilek – Vanilya
– Çilek – Çilek – Çikolata
– Çikolata – Çikolata – Vanilya
– Çikolata – Çikolata – Çilek
– Vanilya – Çikolata – Çilek
4- a → Birinci Atom
b → İkinci Atom
– aa–bb–ab
5- a → Birinci Atom
b → İkinci Atom
c → Üçüncü Atom
– aaa–bbb–ccc–aab–abb–abc–bbc–ccb–acc–aac
6- Doğada 100 den fazla farklı çeşitte atom vardır. Bunlar, ikili, üçlü, … gibi farklı şekillerde bir araya gelerek sayılamayacak kadar çok çeşitte madde oluşur.
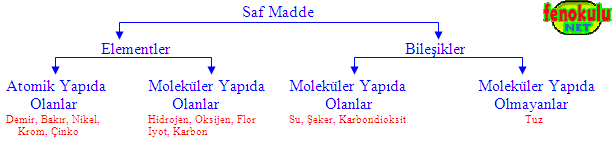
3- Bileşikler ve Bileşiklerin Özellikleri :
a) Bileşikler :
İki ya da daha fazla çeşit element atomunun bir araya gelerek oluşturdukları yeni saf maddeye bileşik denir. Farklı atom içeren moleküller (çok sayıdaki molekül) bir araya gelerek görünecek boyuta ulaştıklarında bileşikler oluşur.
(İki ya da daha fazla elementin kendi özelliklerini kaybederek belirli oranlarda ve kimyasal tepkimeler sonucu oluşturdukları saf maddelere bileşik denir).
Bileşikler kendini oluşturan atomlardan (elementlerden) farklı özelliklere sahiptirler. Bileşiği oluşturan atomlar kendi özelliklerini kaybederler. (Helva, kendini oluşturan un, yağ ve şekerden farklı tada ve özelliğe sahiptir).
Bileşiklerin çoğu moleküllerden oluşmuşlardır. Bir bileşiği oluşturan moleküllerden her biri bileşikteki diğer moleküllerle aynı sayıda ve aynı cinste atom içerir. (Bileşikteki moleküllerin hepsi aynı sayıda ve aynı cinste atom içerir).
Doğada bilinen 115 çeşit atom vardır. Bu atomlar farklı çeşitlerde ve şekillerde bir araya gelerek milyonlarca farklı madde yani bileşik oluşur.
Bileşikler atomik yapıda değildirler.
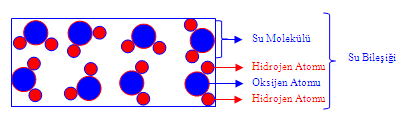
Örnek : • Su bileşiktir ve su bileşiğini oluşturmak için çok sayıda su molekülü bir araya
gelir. Su bileşiğini oluşturan moleküllerden her biri suyun diğer molekülleri ile aynı sayıda ve cinste atom içerir. Bir su molekülü iki hidrojen ve bir oksijen atomundan oluşur.
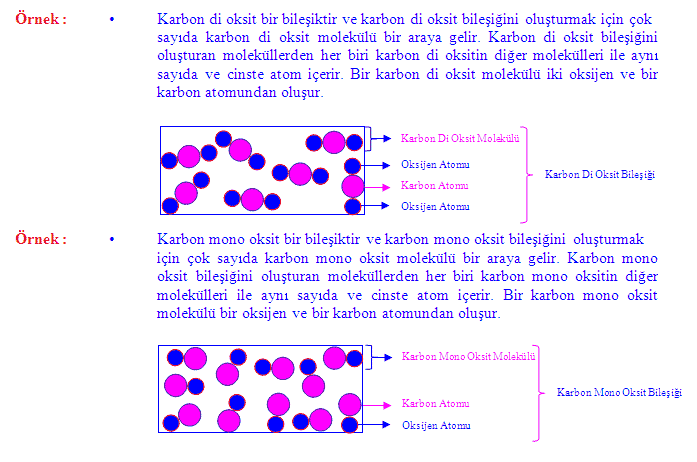
b) Bileşik Çeşitleri :
1- Moleküler Yapıdaki Bileşikler :
Bileşikler iki ya da daha fazla atomdan oluşan moleküllerden oluşmuşsa böyle bileşiklere moleküler yapılı bileşikler denir. Moleküler yapılı bileşikler moleküllerden oluşurlar.
Örnek : • Şeker bileşiği moleküler yapıdadır ve her molekül 24 atomdan oluşur.

Glikoz = C6H12O6
• Su bileşiği moleküler yapıdadır ve her molekül 3 atomdan oluşur.

2- Moleküler Yapıda Olmayan Bileşikler :
Bileşikler, ikili ya da daha fazla atomdan oluşan moleküllerden oluşmayıp, bileşiği oluşturan atomlar bir yığın oluşturacak şekilde dizilmişlerse böyle bileşiklere moleküler yapılı olmayan bileşikler denir.
Moleküler yapıda olmayan bileşikleri oluşturan yığınlardaki atomlar sayılamayacak kadar çoktur ve yığındaki atomun sayısı yığının büyüklüğüne göre değişir. Fakat moleküler yapıdaki bileşikleri oluşturan moleküllerdeki atomlar sayılabilirler ve moleküldeki atom sayısı değişmez.
Örnek : • Tuz bileşiği moleküler yapıda değildir, yığın görünümündedir.
Tuzluktan dökülen bir tuz kristalinde sayılamayacak kadar çok sayıda atom bulunur.

c) Bileşiklerin Özellikleri :
1- Bileşikler, kendini oluşturan elementlerin (atomları) özelliklerini göstermezler.
2- Bileşiği oluşturan elementler (atomlar) kendi özelliklerini kaybederler.
3- Bileşiği oluşturan elementler belirli oranlarda birleşirler.
4- Bileşikler oluşurken enerji alışverişi olur.
5- Bileşikler, kimyasal tepkimelerle oluşur ve kimyasal yollarla ayrılırlar.
6- Bileşikler en az iki farklı elementten yani atomdan oluşurlar.
7- Bileşiklerin belirli erime, kaynama, donma ve yoğunlaşma sıcaklıkları vardır.
8- Bileşikler saf ve homojen maddelerdir.
9- Bileşikler formüllerle gösterilirler.
10- Bileşiklerin en küçük yapı birimleri moleküllerdir.
SORU : 1- Doğada bilinen 116 element ve bu nedenle 116 atom olmasına rağmen
doğada milyonlarca farklı madde bulunmasının nedeni nedir?
2- Bütün bileşiklerin molekülü var mıdır?
13. Etkinlik : Şekillere Bak, Kutuları Doldur (Çalışma Kitabı – 55)
Amaç : Atomik ve moleküler yapıdaki element ve bileşiklerin tespit edilerek konunun
pekiştirilmesinin sağlanması.
Yapılacaklar : • Maddelerin tanecikli yapılarını gösteren modellerle ilgili olarak
verilen soruların cevabı kutucuklara uygun ifadelerle yazılır.
9. Etkinlik : Her Maddede Molekül Var mı? (Ders Kitabı – 105)
Amaç : Bileşiği sadece moleküllerin oluşturmayacağını kavramak.
Yapılacaklar : • Bileşik modelleri incelenerek moleküler yapıda olan ve olmayan
şekilde sınıflandırırlar.
• Kartlarda CO2, H2O, NaCl, şeker bulunmaktadır. (Bileşik isimleri verilmeyecektir).
• Molekül içeren modellerin kaç tane atom içerdikleri sorularak molekül içermeyen modeldeki atomların sayılamayacak kadar çok olduğuna dikkat çekilir.
• Sonuca Varalım Kısmında;
– Molekülü oluşturan atomların sayılıp sayılamadığına.
– Molekülleri oluşturan tanecikler sayılamayacak kadar çok ve yığın halinde.
14. Etkinlik : Yolumuzdaki Bileşikleri Toplayalım (Çalışma Kitabı – 56)
Amaç : Element ve bileşiklere ait modellerin tespit edilmesinin sağlanması.
Yapılacaklar : • Bileşiği oluşturan moleküller bulunur.
• Elementi oluşturan moleküller bulunur.
• Molekülü olan bileşikler ile molekülü olmayan bileşikler ayırt edilir.
• Toplanan bileşiklerden elementlere ait olanlar bir kutucuğa, bileşiklere ait olanlar diğer kutucuğa çizdirilir.
15. Etkinlik : Tanecikleri Ayırt Edelim (Çalışma Kitabı – 57)
Amaç : Element ve bileşikleri, atomik ve moleküler yapıda olan elementler ile
moleküler yapıda olan ve olmayan bileşiklerin tespit edilmesinin sağlanması.
Yapılacaklar : • Verilen tanecik modelleri ile ilgili sorular cevaplandırılır.
• a) Elementi → 1–2–7–8–9
b) Bileşiği → 3–4–5–6
• a) Atomik Yapı → 7–8
b) Moleküler Yapı → 1–2–3–4–5–9
• a) Elemente → 1–2–9
b) Bileşiğe → 3–4–5
• 6
Kendimizi Değerlendirelim : (Ders Kitabı – 107)
1- Benzerlikler;
– Tanecikli yapıya sahiptir.
– Moleküllü yapıları vardır.
– Tanecikler bir araya geldiklerinde molekülleri oluştururlar.
Farklılıklar;
– Elementler tek çeşit, bileşikler en az iki çeşit atomdan oluşurlar.
– Elementler atomik yapıda bulunu, bileşikler bulunmaz.
– Bileşiklerin moleküler yapıda olmayanlar vardır, elementlerin yoktur.
2- Demir ve bakır elementlerinin atomlarının büyüklükleri farklıdır. Farklı elementlerin atomlarının büyüklükleri de farklıdır.
3- İkisi de bakırdan yapıldığı için bakır atomlarından oluşur ve atomların büyüklükleri aynıdır.
4- III numaralı modelde atomlar birbirine karışmış durumda olduğu için bu model moleküler yapıda değildir.
Hazırlayan: MURAT ÜSTÜNDAĞ
|
|
Element , Bileşik ve Karışımlar (Konu Anlatımı)
|
|
ELEMENTLER :
Aynı cins atomlardan oluşan saf maddelere “element” denir.
Örnekler : Demir, bakır, gümüş, altın, oksijen, hidrojen, iyot ve karbon birer elementtir.
* Farklı cins atomlar içeren maddeler, element olamaz.
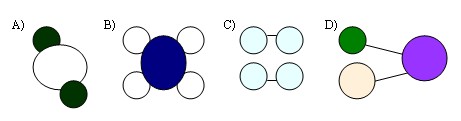
SORU : Aşağıda verilen madde modellerinden hangisi element değildir?

ÇÖZÜM : A,B ve C seçeneklerindeki madde modellerini incelediğimizde bu modellerin aynı cins atomlardan oluştuklarını görürüz. Ancak D seçeneğindeki modelde farklı cins atomlar olduğu için bir element olamaz.
BİLEŞİKLER :
Aynı tür atomlardan oluşan maddelere element dendiğini öğrendik. O halde farklı cins atomlardan oluşan maddelere ne ad verilir?
Doğada; tuz, su, sabun, şeker, alkol gibi farklı cins atomlar içeren pek çok madde vardır. Farklı cins atomlardan oluşan saf maddelere “bileşik” denir.
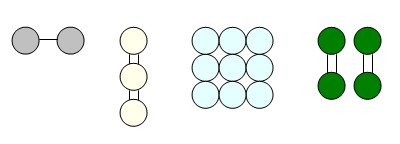
SORU : Aşağıdaki madde modellerinden hangisi bileşik değildir?
ÇÖZÜM : A, B ve D seçeneklerindeki modelleri incelediğimizde farklı cins atomlardan oluştuklarını görürüz. Ancak C seçeneğindeki model, aynı cins atomlardan oluşmuştur. Dolayısıyla A, B ve D seçenekleri bileşik, C seçeneği ise elementtir.
MOLEKÜLLER :
Birden fazla atomun bir arada bulunduğu atom gruplarına “molekül” denir.
Moleküller 2’ye ayrılır :
• Element molekülü
• Bileşik molekülü
ELEMENT MOLEKÜLLERİ :
Aynı cins atomlardan oluşan moleküllere “element molekülü” denir.
Element moleküllerine örnekler :
BİLEŞİK MOLEKÜLLERİ :
Farklı cins atomlardan oluşan moleküllere “bileşik molekülü” denir.
Bileşik moleküllerine örnekler :
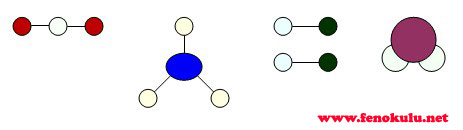
|
|
Suyun Genleşmesi ve ilginç özellikleri
|
|
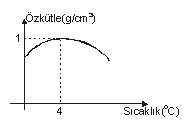
Sıvılar ısıtılınca hacimleri artar. Yalnız suyun özel bir durumu vardır. +4C sıcaklıkta suyun hacmi minimumdur. +4C deki suyu ısıtır veya soğutursak, hacmi artar.
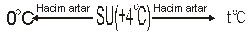
Hacim ile özkütle ters orantılı olduğunda suyun özkütle-sıcaklık grafiği aşağıdaki gibi olur.
Gazların Genleşmesi: Gazlarda ısı karşısında genleşirler. Gazların genleşmesi sadece hacimce olur. Genleşme katsayısı bütün gazlarda aynıdır. Bütün gazların sıcaklıkları 1C değiştiğinde hacimlerinin 1/273 ü kadar genleşirler. Bu nedenle genleşme gazlar için ayırt edici bir özellik değildir.
MUCİZE MOLEKÜL: SU-1
Suyun Olağanüstü Termal Özellikleri
Henderson'ın kitabında üzerinde durulan konulardan biri, suyun termal (ısıyla ilgili) özellikleridir. Henderson, suyun termal özelliklerinin beş ayrı yönden çok ilginç olduğuna dikkat çeker. Bunlar sırasıyla şöyledir:
1) Bilinen tüm maddeler ısıları düştükçe büzüşürler. Bilinen tüm sıvılar da yine ısıları düştükçe büzüşür, hacim kaybederler. Hacim azalınca yoğunluk artar ve böylece soğuk olan kısımlar daha ağır hale gelir. Bu yüzden sıvı maddelerin katı halleri, sıvı hallerine göre daha ağırdır. Ama su, bilinen tüm sıvıların aksine, belirli bir ısıya (+ 4°C'ye) düşene kadar büzüşür, ama sonra birdenbire genleşmeye başlar. Donduğunda ise daha da genleşir. Bu nedenle suyun katı hali, sıvı halinden daha hafiftir. Yani buz, aslında "normal" fizik kurallarına göre suyun dibine batması gerekirken, su üstünde yüzer.
2) Buz eridiğinde ya da su buharlaştığında, etraftan ısı çekilir. Bunun tersi gerçekleştiğinde ise, dışarıya ısı verilir. Bu "gizli ısı" olarak bilinen kavramdır.
Gizli ısı, suyun ısısını değiştirmeyen, ancak sadece onun katıdan sıvıya ya da sıvıdan gaz haline geçmesini sağlayan ısıdır. Bir buzu eritmek için ona ısı verdiğinizde, buz 0°C'ye kadar gelir. Sonra biraz daha ısı verirsiniz, buzun ısısında hiçbir artış olmaz, hala 0°C'dir. Ama artık buz değildir, eriyip su olmuştur. Isıda bir fark olmamasına rağmen, sadece katı halin sıvıya dönüşmesi için kullanılan bu enerjiye "gizli ısı" denir.
Tüm sıvıların gizli ısıları vardır. Ancak suyun gizli ısısı, bilinen tüm sıvıların en yükseği sayılabilir. Normal ısılarda, sadece amonyak sudan daha yüksek bir donma gizli ısısına sahiptir. Buharlaşma gizli ısısında ise hiçbir sıvı, su ile boy ölçüşemez.
3) Suyun "termal kapasitesi", yani suyun ısısını bir derece artırmak için gereken ısı miktarı, bilinen diğer sıvıların çok büyük bölümünden daha yüksektir.
4) Suyun termal iletkenliği, yani ısıyı iletebilme yeteneği, bilinen diğer herhangi bir sıvıdan en az dört kat daha yüksektir.
5) Buzun ve karın termal iletkenlikleri ise düşüktür.
Teknik birer fiziksel özellik gibi duran yukarıdaki beş maddenin ne gibi bir öneme sahip olduğunu merak edebilirsiniz. Bunlar çok büyük birer öneme sahiptir, çünkü dünya üzerindeki yaşam ve bizim hayatımız, bu üstteki özelliklerin tam tamına bu şekilde olması sayesinde mümkündür.
Şimdi sırasıyla bu özelliklerin etkilerini inceleyelim.
Üstten Donmanın Etkisi
Suyun yukarıdaki birinci maddede anlatılan özelliği, Dünya üzerindeki denizler açısından çok önemlidir. Eğer bu özellik olmasa, yani buz suyun üzerinde yüzmese, Dünya üzerindeki suyun çok büyük bir bölümü tamamen donacak, göllerde ve denizlerde hiçbir yaşam kalmayacaktı.
Bu gerçeği biraz detaylı olarak inceleyelim. Dünya'nın pek çok yerinde soğuk kış günlerinde ısı 0°C'nin altına düşer. Bu soğuk elbette denizleri ve gölleri de etkiler. Bu su kütleleri giderek soğurlar. Soğuyan tabakalar dibe doğru çöker, daha sıcak kısımlar yüzeye çıkar, ama bunlar da havanın etkisiyle soğur ve yine dibe doğru çöker. Ancak bu denge sıcaklık 4°C'ye gelince birden değişir, bu kez ısının her düşüşünde, su genleşmeye ve hafiflemeye başlar. Böylece 4°C'lik su en altta kalır. Daha yukarıda 3°C, onun üstünde 2°C, böylece devam eder. Suyun yüzeyi ise 0°C'ye vararak donar. Ama sadece yüzey donmuştur. Yüzeyin altında kalan 4°C'lik bir su tabakası, balıkların ve diğer su canlılarının yaşamlarını sürdürmeleri için yeterlidir.
(Bu arada suyun yukarıdaki beşinci maddede değindiğimiz özelliği de çok büyük bir işlev görmektedir: Bu özellik, buzun ve karın termal iletkenliklerinin düşük olmasıdır. Yani buz, havadaki soğuğu, altındaki su tabakasına çok az iletir. Böylece dışarıdaki hava –50°C'yi bulsa bile, denizin üstündeki buz tabakası bir-iki metreyi geçmez. Foklar, penguenler ve diğer kutup hayvanları, bu sayede denizin üstündeki buzu delip alttaki suya ulaşabilirler.)
Eğer böyle olmasa ne olurdu? Su "normal" davransaydı, tüm diğer sıvılar gibi onun da ısı kaybına paralel olarak yoğunluğu artsaydı, yani buz suyun dibine batsaydı ne olurdu?
Suyun üstten donma özelliği sayesinde, Dünya’daki denizler yüzeyde oluşan buz tabakalarına rağmen her zaman için sıvı olarak kalırlar. Eğer su bu “olağanüstü” özelliğe sahip olmasaydı, denizlerin tamamına yakını sürekli olarak donacak ve deniz yaşamı imkansız hale gelecekti.
Bu durumda okyanuslar, denizler ve göllerde, donma alttan başlayacaktı. Alltan başlayan donma, yüzeyde soğuğu kesecek bir buz tabakası olmadığı için, yukarı doğru devam edecekti. Böylece Dünya'daki göllerin, denizlerin ve okyanusların çok büyük bölümü dev birer buz kütlesi haline gelecekti. Denizlerin yüzeyinde sadece birkaç metrelik bir su tabakası kalacak ve hava sıcaklığı artsa bile, dipteki buz asla çözülmeyecekti. Böyle bir Dünya'nın denizlerinde hiçbir canlı yaşayamazdı. Denizlerin ölü olduğu bir ekolojik sistemde kara canlılarının varlığı da mümkün olamazdı. Kısacası Dünya, eğer su "normal" davransaydı, ölü bir gezegen olacaktı.
Suyun neden "normal" davranmadığı, yani 4°C'ye kadar büzüştükten sonra neden birdenbire genleşmeye başladığı ise, hiç kimsenin cevaplayamadığı bir sorudur.
|
|
MADDELERİN SINIFLANDIRILMASI
|
|
MADDE: Madde nedir? Maddenin özelliklerinden bahsedilecek. Kütlesi, hacmi ve eylemsizliği olan her şeye madde denir.
Madde üç halde bulunur: Katı, sıvı ve gaz.
MADDENİN ÖZELLİKLERİ
Ortak Özellikler
Bütün maddelerde bulunan özeliktir. KÜTLE ve HACİM
Ayırt edici özellikler
Bir maddeyi diğer maddeler den ayırt etmeyi sağlar. ÖZKÜTLE ,ÖZISI, ÇÖZÜNÜRLÜK, ERİME VE KAYNAMA NOKTASI,GENLEŞME, ESNEKLİK,İLETKENLİK
MADDELERİN SINIFLANDIRILMASI
• Katı (toprak,taş,odun
• Sıvı (su,zeytinyağı, alkol)
• Gaz (hava,hidrojen,oksijen)
Katı Hali:Katı halde,
• Madde belirli bir şekle ve hacme sahiptir.
• Maddeyi oluşturan tanecikler birbirine çok yakındır ve düzenli bir yapıdadır.
• Hareket enerjisi düşüktür.
Sıvı hali,
• Sıvı halde maddenin belli bir hacmi vardır.
• Fakat belli bir şekli yoktur.Bulunduğu kabın şeklini alır.
• Tanecik arası boşluk katıya göre çoktur.
• Tanecikler düzenli olarak dizilmediği gibi birbiri üstünden kayarak hareket eder.Bu sıvıya akışkanlık özelliği kazandırır .
Gaz hali ,
• Gaz halde ise taneciklerin enerjisi çok fazladır ve tanecikler arası mesafe çok fazladır.Bu yüzden gazlar bulundukları kabın her tarafını doldururlar.
• Gazların belli bir şekli yoktur.
HAL DEĞİŞTİRME:
Erime: Bir maddenin katı halden sıvı hale geçmesine denir. Eriyen madde çevreden ısı alır.
Donma: Sıvı bir maddenin katı hale geçmesine denir. Sıvı donarken çevresine ısı verir.
Buharlaşma: Sıvı bir maddenin gaz hale geçmesine denir. Buharlaşan madde çevreden ısı alır.
Yoğunlaşma: Gaz maddenin sıvı hale geçmesine denir. Yoğunlaşan madde çevreye ısı verir.
Kaynama: Sıvılar her sıcaklıkta buharlaşır. Fakat buharlaşmanın en yoğun olduğu ana kaynama denir. Bu andaki sıcaklığa da kaynama noktası denir.
Katının eriyip sıvılaştığı sıcaklığa erime noktası Sıvının katı hale geçtiği sıcaklığa donma noktası denir. Erime donmanın, buharlaşma yoğunlaşmanın tersidir.
Çevre Bilinci
Gezegenimizin yapısında maddenin üç hali de mevcuttur. Hava, su buharı gaz hali; su, lavalar sıvı hali; kayalar, madenler, buz dağları katı haline örnek olarak verilebilir. Maddenin tüm bu halleri yaşamamızın mükemmel şekilde devam etmesi içindir. Çevremizdeki bu düzeni bozmamaya özen göstermeliyiz.
|
|
MADDELERİN SINIFLANDIRILMASI
|
|
MADDE: Madde nedir? Maddenin özelliklerinden bahsedilecek. Kütlesi, hacmi ve eylemsizliği olan her şeye madde denir.
Madde üç halde bulunur: Katı, sıvı ve gaz.
MADDENİN ÖZELLİKLERİ
Ortak Özellikler
Bütün maddelerde bulunan özeliktir. KÜTLE ve HACİM
Ayırt edici özellikler
Bir maddeyi diğer maddeler den ayırt etmeyi sağlar. ÖZKÜTLE ,ÖZISI, ÇÖZÜNÜRLÜK, ERİME VE KAYNAMA NOKTASI,GENLEŞME, ESNEKLİK,İLETKENLİK
MADDELERİN SINIFLANDIRILMASI
• Katı (toprak,taş,odun
• Sıvı (su,zeytinyağı, alkol)
• Gaz (hava,hidrojen,oksijen)
Katı Hali:Katı halde,
• Madde belirli bir şekle ve hacme sahiptir.
• Maddeyi oluşturan tanecikler birbirine çok yakındır ve düzenli bir yapıdadır.
• Hareket enerjisi düşüktür.
Sıvı hali,
• Sıvı halde maddenin belli bir hacmi vardır.
• Fakat belli bir şekli yoktur.Bulunduğu kabın şeklini alır.
• Tanecik arası boşluk katıya göre çoktur.
• Tanecikler düzenli olarak dizilmediği gibi birbiri üstünden kayarak hareket eder.Bu sıvıya akışkanlık özelliği kazandırır .
Gaz hali ,
• Gaz halde ise taneciklerin enerjisi çok fazladır ve tanecikler arası mesafe çok fazladır.Bu yüzden gazlar bulundukları kabın her tarafını doldururlar.
• Gazların belli bir şekli yoktur.
HAL DEĞİŞTİRME:
Erime: Bir maddenin katı halden sıvı hale geçmesine denir. Eriyen madde çevreden ısı alır.
Donma: Sıvı bir maddenin katı hale geçmesine denir. Sıvı donarken çevresine ısı verir.
Buharlaşma: Sıvı bir maddenin gaz hale geçmesine denir. Buharlaşan madde çevreden ısı alır.
Yoğunlaşma: Gaz maddenin sıvı hale geçmesine denir. Yoğunlaşan madde çevreye ısı verir.
Kaynama: Sıvılar her sıcaklıkta buharlaşır. Fakat buharlaşmanın en yoğun olduğu ana kaynama denir. Bu andaki sıcaklığa da kaynama noktası denir.
Katının eriyip sıvılaştığı sıcaklığa erime noktası Sıvının katı hale geçtiği sıcaklığa donma noktası denir. Erime donmanın, buharlaşma yoğunlaşmanın tersidir.
Çevre Bilinci
Gezegenimizin yapısında maddenin üç hali de mevcuttur. Hava, su buharı gaz hali; su, lavalar sıvı hali; kayalar, madenler, buz dağları katı haline örnek olarak verilebilir. Maddenin tüm bu halleri yaşamamızın mükemmel şekilde devam etmesi içindir. Çevremizdeki bu düzeni bozmamaya özen göstermeliyiz.
|
|
MADDENİN 4. HALİ PLAZMA
|
|
Düşen ve Çakan Plazma
Şiddetli gök gürültülerinin eşliğinde bardaktan boşanırcasına yağan yağmuru yüksekçe bir evin penceresinden seyretme fırsatını yakaladıysanız, hele bir de üstüste çakan şimşekler karşınızdaki bulutların arasında meydana geliyorsa, en pahalı havai fişek gösterilerinin yanında sönük kaldığı muhteşem bir ışık gösterisine şahit olursunuz. Bu ışık gösterisi büyüleyici olduğu kadar ürkütücü hâli ile de Yaratıcı'nın celâl ve cemâl sıfatını aynı anda sergiler. Bulutların sürtünme ile elektriklenmesinden kaynaklanan bir elektrik boşalması olduğu herkesçe bilinen şimşek ve yıldırım, yüz milyonlarca voltluk potansiyel farkı sıfırlanana kadar yaklaşık 20.000 Amperlik bir akım şiddetinde ve aktığı kanalda 30.000 Kelvin (K)'lik bir sıcaklık meydana getirerek akar ve bu olay bir saniyeden daha kısa sürer. Bu yüzden yıldırımın ürkütücü yanının küçümsenmemesi ve gereken yerlerde tedbir alınması yerinde bir harekettir.
Yıldırım, bulut ile yeryüzü arasındaki potansiyel farkı havayı delecek bir büyüklüğe (delinme gerilimi) ulaştığı anda meydana gelir. Bu anda akım şiddeti çok yüksek olduğundan, boşalma elektrik arkı şeklindedir. Buluttaki negatif yüklü serbest elektronlar ve yerdeki pozitif yüklü iyonlar bulutla yer arasındaki potansiyel farkını sıfırlamak için birbirine doğru büyük bir hızla harekete başlar. Elektronlar iyonlardan çok daha küçük olduklarından hızları çok yüksektir. Bu yüzden iki akım yere oldukça yakın bir yükseklikte birleşirler. Elektronların buluttan yere doğru hareketi ile birlikte akımın geçtiği yol boyunca iyonizasyon süreci başlamış olur. Elektronlar hızla çarptıkları hava atomlarından bazen elektron koparırken, bazen de bu elektronlar iyonlar tarafından yakalanırlar ve iyon nötral atom hâline gelir. İşte yıldırımın parlak ışığı, iyonlarca yakalanan bu elektronların fazla enerjilerini fotonlar şeklinde dışarıya neşretmesi neticesi oluşur. Böylece yıldırımın aktığı yol; nötral atom ve moleküller, uyarılmış atom ve moleküller, pozitif iyonlar, elektronlar ve fotonlardan oluşan çok sıcak bir gaz çorbası hâline gelir. Bu ideal gaz kanunu sağlayan bir hâl olmasına rağmen; gaz hâlinden çok farklı özellikler taşıdığından, maddenin dördüncü hâli olarak kabul edilir ve "plazma" hâli olarak bilinir.
Yıldırım örneğine bakarak plazma hâlini gaz hâlinden ayıran önemli özellikleri hemen görebiliriz. Bunlar çok yüksek sıcaklık ve elektrik iletkenliğidir. Bütün maddelerin gaz hâli yalıtkan olduğu hâlde, plazma hâli elektriği son derece iyi iletir. Hattâ bu iletkenlik katı iletkenlerden de daha iyidir, çünkü plazma hâli tamamen serbest elektronlara sahiptir. Yıldırım, bu olağanüstü özellikleri ile günlük hayatımızda kullandığımız fluoresan ve neon lâmbalarına ve metallerin kaynak edilmesinde kullandığımız elektrik arkına ilham kaynağı olmuştur. Son olarak, ark oluşması, yani plazma hâli ile elektrik boşalması oluşabilmesi için gereken "delinme gerilimi" miktarına bir örnek verelim: Bu değer 1 cm hava aralığı için 30.000 Volttur. Ancak lâmbalarda daha düşük delinme gerilimine sahip neon, cıva buharı gibi gazlar kullanılır.
Çak Bir Plazma
Eğer "ben plazmaya daha yakından bakmak istiyorum" diyorsanız, yapmanız gereken çok basit. Kibriti elinize alın ve çakın. İşte pırıl pırıl alevi ile plazma karşınızda duruyor. Evet alev de bir plazma hâlidir. Alevin kibritteki sıcaklığı kibritin elinizle söndürebileceğiniz kadar düşük olabileceği gibi Güneşin çekirdeğindeki gibi milyonlarca santigrad kadar yüksek de olabilir. Plazma hâli sadece elektrikî gerilim altında oluşmaz. Gaz hâline gelen bir maddeyi çok yüksek sıcaklıklara ısıtırsanız; enerji alanı elektronlar çekirdeklerinden kurtulur ve gaz plazma hâline geçer. Sıcaklık güneş çekirdeğindeki gibi çok yüksek ise; atomlar tüm elektronlarını kaybetmiş hâlde bulunabilirler. Bizim günlük hayatımızda kullandığımız alev nispeten düşük sıcaklıktadır. Ancak burada düşük sıcaklıktaki alevin enerjisi ile ısınma ve yemek pişirme gibi ihtiyaçlarımızı giderdiğimizi unutmayalım. Bu arada çaktığınız kibrit bitmek üzere. En iyisi siz onunla bir mumu tutuşturup plazmayı öyle seyredin. Mumun alevi de düşük sıcaklıkta bir plazma hâlidir. Ancak "bu sıcaklık bana yetmez" demeyin. Yıllar önce merhum Barış Manço'nun bir programında konuk ettiği bir grup insan masanın etrafına oturmuş, mum alevi ile altını ergiterek zincir yapıyorlardı. Altın 1066 oC'de ergir. Mumun normal alevi ile altın ergitmeniz mümkün değildir. Altın işleyen bu insanlar ağızlarındaki ince bir boru ile üfleyerek mumun alevini küçültüyorlardı. Bu şekilde küçülerek mavileşen alevin sıcaklığı artıyor ve altını ergitebilecek sıcaklığa erişiyordu. Bu anlattığımız hâdise plazmaya yapabileceğimiz etkilerden biridir. Plazmayı etrafından eşit miktarda soğutursak plazmanın kesiti küçülür, böylece enerji yoğunluğu, dolayısıyla sıcaklığı artar. Bu hâdiseye "termik sıkıştırma" adı verilir ki, aynı yöntem arkı sıkıştırmak için kaynak işleminde de uygulanır. Son olarak alevin iletkenliğinden bahsedelim. Alev bir plazma hâli olduğundan elektriği iletir. Bu özelliğinden faydalanarak gaz emniyetli sobalar yapılmıştır. Bu sobalar yanarken alevin içerisinden elektrik akımı geçirilir. Bu elektrik akımı sobanın gaz pompasını çalıştırır. Alev herhangi bir sebeple sönerse akım geçmeyeceğinden gaz otomatik olarak kesilmiş olur.
Plazma, Heryerde Plazma
Maddenin plazma hâline dünya üzerinde çok az rastlamamıza rağmen kâinatta plazma hâli fazlalık bakımından maddenin diğer hâllerine karşı ezici bir üstünlüğe sahiptir. Şöyle ki; kâinattaki toplam madde miktarının % 99'unun plazma hâlinde olduğu sanılmaktadır. Örnek verecek olursak tüm yıldızlar, nebulalar ve yıldızlararası uzay plazma hâlindeki maddeden oluşur. Bunların sıcaklığı ve partikül yoğunluğu şekil üzerinde gösterilmiştir. Birim hacimdeki partikül yoğunluğu da plazmanın bilinmesi gereken bir özelliğidir. Sıcaklığı yüksek olsa da, yoğunluğu düşük bir plazma fazla enerji yaymaz. Kâinatın boşluk diyebileceğimiz madde yoğunluğu çok düşük olan bölgelerinde ise; sıcaklık 3 K yani -270 C derece kadardır. Bir yanda hiç bir canlının hattâ cansızların bile mukavemet edemeyeceği kadar yüksek bir sıcaklık, diğer yanda atomları bile donduracak derecede bir soğuk. Bunların ortasında mükemmel techizatlarla donatılarak koruma altına alınan cennet gibi bir dünya....
Hayat Kaynağı Plazma Küresi
Işık ve ısı kaynağı olarak dünyamızda hayatın devamını sağlayan Güneş dev bir plazma küresidir. Bu dev plazma küresinin çekirdeğindeki 15 milyon K'lik sıcaklık ve kurşundan 11 kat daha fazla olan yoğunluk, termonükleer reaksiyonların gerçekleşmesini sağlar. Bu reaksiyonlarda özetle hidrojen çekirdekleri birleşerek helyum çekirdeklerine dönüşür ve muazzam bir enerji açığa çıkar. Ancak dünyamıza ısı göndererek hayatın devamını sağlayan ışıkkürenin sıcaklığı ancak 6.000 K'dir. Bu tabakanın üzerinde yer alan ve korona adı verilen güneş tacının 2 milyon K'lik sıcaklığının sebebi ise tam anlaşılamamıştır. Bu tabaka dünyanın da ötesine uzanır ancak çok düşük yoğunlukta olduğu için sıcaklık tesiri fazla değildir. Bu tabakanın yoğunluğu ışıkküre gibi yüksek olsaydı dünya üzerinde hayat mümkün olmazdı. Yine güneşten kopup gelen elektrik yüklü parçacıkların, dünya atmosferine yapabileceği muhtemel etkiler dünyanın manyetik alanı tarafından önlenmiştir. Bu manyetik alana manyetosfer adı verilir. Güneş'in oluşturduğu yüklü parçacık, akımı bu manyetik alan tarafından saptırılarak kutup bölgelerine doğru itilir. Bunun sonucunda kutup bölgelerinde atmosferin oksijen ve azot atomları ile etkileşime girerek ışımalara sebep olurlar ki bunlara aurora adı verilir. Auroralar yaklaşık ikiyüz km yüksekte oluşurlar ve sıcaklıkları bir kaç yüz derecedir. Güneş etkinliğinin yüksek olduğu günlerde telsiz ve radyo haberleşmelerinin olumsuz etkilendiğini hatırlarsak manyetosferin önemi daha iyi anlaşılır.
Manyetosfer örneği plazmanın bir özelliğini daha ortaya koyar ki bu da plazmaya manyetik veya elektrik alanı ile etki edilebilmesidir. Plazma yıldırımda veya kaynak arkında olduğu gibi elektrik akımı oluşturuyorsa, etrafında bir manyetik alan oluşacaktır. Bu manyetik alana yabancı bir manyetik alanla tesir edilebilir. Böylece plazmaya etkiyen kuvvetin yönü değiştirilebilir. Bu etki termik sıkıştırmada olduğu gibi tüm çevresinden yapılarak plazmanın kesitini küçültmek de mümkündür. Böylece plazmanın sıcaklığı artırılmış olur ki, çekirdek füzyonu reaktörlerinde bu yolla 250 milyon K'lik bir sıcaklığa erişilmiştir. Ancak bu reaktörlerde yeterli parçacık yoğunluğuna ulaşılamadığından, henüz hidrojeni helyuma çevirmek ve enerji üretmek mümkün olmamıştır. Eğer bu yolla enerji üretmek mümkün olursa, yakıt olarak deniz suyunda oldukça bol bulunan ağır su kullanılacak ve böylece dünya üzerindeki enerji ihtiyacı temiz bir şekilde ucuz olarak karşılanabilecektir. Ayrıca termonükleer tepkime hidrojen bombasında olduğu gibi yok edici bir gâyeye değil, insanların mutluluğuna hizmet etmiş olacaktır. Güneş gibi bir plazma küresinde oluşturduğu termonükleer reaksiyonlarla dünyayı yaşanabilir kılan Yaratıcı'nın, insanlara bir mesajı da bu olabilir mi?
|
|
Karışımlar
|
|
KARIŞIMLAR :
Elementlerin aynı cins atomlardan, bileşiklerin ise farklı cins atomlardan oluştuğunu öğrendik. Peki, hem farklı cins atomlardan hem de farklı cins moleküllerden oluşan maddelere ne ad verilir?
Aynı cins atom veya moleküllerden oluşan maddelere “saf madde” denir. Elementler ve bileşikler saf maddelerdir.
Farklı cins atomlardan ve farklı cins moleküllerden oluşan maddelere “karışım” denir. Karışımlar saf olmayan maddelerdir.
Karışım modellerine örnekler :
KARIŞIM ÇEŞİTLERİ :
HOMOJEN KARIŞIMLAR :
Dışarıdan bakıldığında tek bir madde gibi görünen karışımlardır. Homojen karışımlara “çözelti” adı verilir.
Örnekler : Tuzlu su, şekerli su, kolonya, hava, metal para vb.
HETEROJEN KARIŞIMLAR :
Her tarafında aynı özelliği göstermeyen karışımlardır.
Örnekler : Çamurlu su, kumlu su, tebeşir tozu katılmış su, ayran, zeytinyağlı su vb.
|
|
MADDELERİN KATI, SIVI, GAZ OLARAK SINIFLANDIRILMASI
|
|
Kütlesi ve hacmi olan, boşlukta yer kaplayan her şeye “madde” denir.
Çevremizde gördüğümüz maddeleri katı, sıvı ve gaz olarak sınıflandırabiliriz.
KATILARIN ÖZELLİKLERİ :
• Katı hali, maddenin en düzenli halidir.
• Katıları oluşturan tanecikler arasındaki boşluklar yok denecek kadar azdır.
• Katı tanecikleri arasındaki çekim kuvveti çok fazladır.
• Katıların belirli bir şekli ve belirli bir hacmi vardır.
• Katılar sıkıştırılamaz.
SIVILARIN ÖZELLİKLERİ :
• Sıvılar, katılara göre daha düzensizdir.
• Sıvıları oluşturan tanecikler arasındaki boşluklar, katılara göre daha fazladır.
• Sıvı tanecikleri arasındaki çekim kuvveti, katılardakine göre daha azdır.
• Sıvıların belirli bir şekli yoktur. Bulundukları kabın şeklini alırlar.
• Sıvıların belirli bir hacmi vardır.
• Sıvılar, akışkandır.
• Sıvılar çok az sıkıştırılabilir.
GAZLARIN ÖZELLİKLERİ :
• Gaz hali, maddenin en düzensiz halidir.
• Gazları oluşturan tanecikler arasındaki boşluklar çok fazladır.
• Gazları oluşturan tanecikler arasındaki çekim kuvveti çok azdır.
• Gazların belirli bir şekli yoktur. Bulundukları kabın şeklini alırlar.
• Gazların belirli bir hacmi yoktur. Bulundukları kabın hacmini alırlar.
• Gazlar, uçucudur.
• Gazlar rahatlıkla sıkıştırılabilir.
|
|
Hava saf maddemidir? Yoksa Karışım mıdır?
|
|
Hava saf madde değildir. Bir maddenin saf madde olması için tek bir elementten oluşması gerekir. Fakat havada oksijen,karbondioksit,çeşitli kirletici gazlar(kükürt ve karbon bileşikleri) , nem gibi birçok farklı madde bulunur. Bu yüzden hava saf değildir. Karışımdır.
|
|

